Un document paru dans la Ion Community (site de partage autour de la technologie Ion Torrent et Ion Proton de Life Technologies) commence à faire parler de lui. En effet, des scientifiques de Life Technologies montrent et démontrent que le MiSeq d’Illumina produit (aussi) des erreurs au niveau des homopolymères.
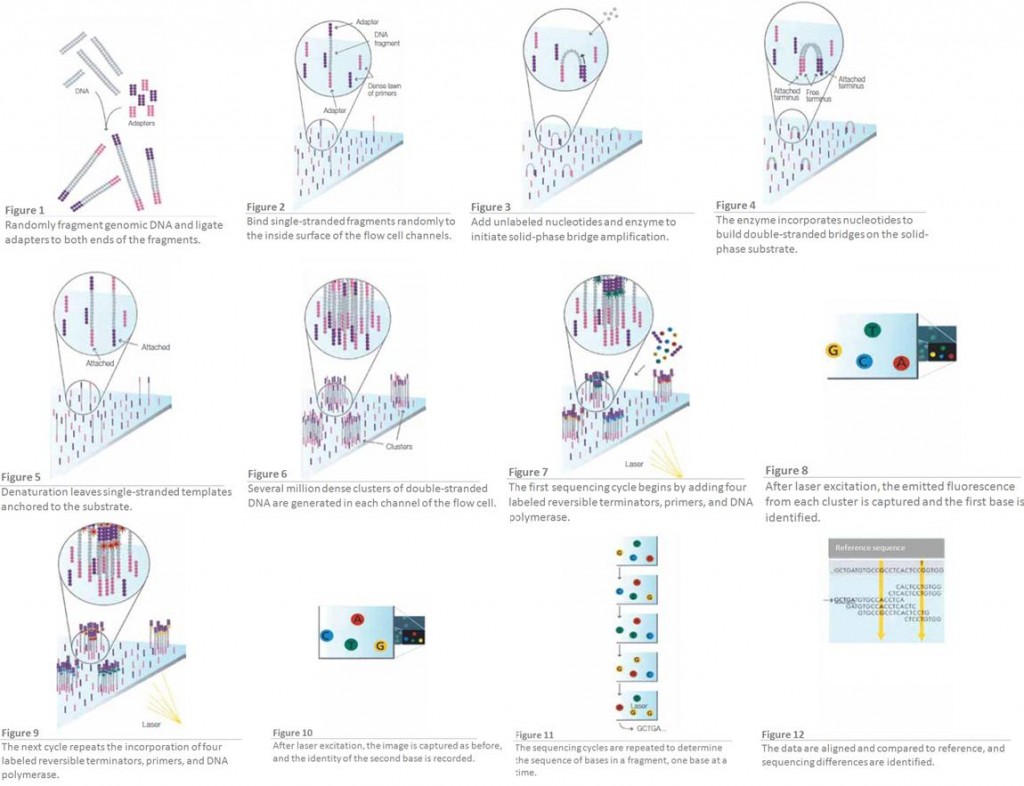
Nous savions depuis longtemps que les séquenceurs de type 454 ou Ion Torrent montraient des biais quant à détermination correcte de ce type de séquences… Ici, pour la première fois les méthodes de SBS (Sequencing By Syntesis) dont le principe pour la technologie Illumina est rappelée par le schéma disponible ci-dessous, montrent des biais étonnement importants pour la juste détermination de séquences adjacentes d’homopolymères (particulièrement concernant les régions GC % riches). La note qui met le feu dans l’argumentaire commercial d’Illumina est disponible ici-même. Une hypothèse quant à la génération de ce type d’erreurs est formulée.
Nous vous laissons le soin de lire la note, intéressante malgré la partialité de la source. La démonstration quoique scientifique, montre l’âpreté de la bataille qui se joue entre les acteurs majeurs du séquençage de paillasse de deuxième génération.
 Cet article est l’occasion de mettre en avant un site plutôt fourni, SEQanswers… un jeu de mots pour une communauté d’utilisateurs de technologie de séquençage haut-débit. Ce site, un peu bouillon, fondé en 2007 par Eric Olivares (qui a travaillé pour Pacific Biosciences) s’adresse aux biologistes moléculaires plus qu’aux bio-informaticiens. Malgré tout, le lien que nous vous présentons ici, renvoie sur la partie Wiki du site SEQanswers. Cette page liste et ordonne en fonction de leurs domaines d’applications les logiciels (gratuits et commerciaux) utiles pour le devenir de vos reads produits par séquençage haut-débit : http://seqanswers.com/wiki/Software/
Cet article est l’occasion de mettre en avant un site plutôt fourni, SEQanswers… un jeu de mots pour une communauté d’utilisateurs de technologie de séquençage haut-débit. Ce site, un peu bouillon, fondé en 2007 par Eric Olivares (qui a travaillé pour Pacific Biosciences) s’adresse aux biologistes moléculaires plus qu’aux bio-informaticiens. Malgré tout, le lien que nous vous présentons ici, renvoie sur la partie Wiki du site SEQanswers. Cette page liste et ordonne en fonction de leurs domaines d’applications les logiciels (gratuits et commerciaux) utiles pour le devenir de vos reads produits par séquençage haut-débit : http://seqanswers.com/wiki/Software/
Cette page est plutôt bien renseignée et vous donnera un large choix de logiciels : vous y trouverez des assemblers de novo, des logiciels pour réaliser du RNAseq (quantification), des logiciels permettant de trouver des pics après ChipSeq… peu de logiciels indispensables sont absents de cette liste qui comporte un peu moins de 500 logiciels…
La paléontologie, la science des fossiles et des traces de vie du passé, use de méthodes de biologie moléculaire de pointe qui pallient les effets du temps qui passe…
Afin d’introduire ce premier article traitant de paléogénomique, les moyens de la biologie moléculaire au service de la paléontologie, une vidéo amuse-bouche (Auteur(s) : Eva-Maria Geigl, Réalisation : Samia Serri, Production : Université Paris Diderot, Durée : 17 minutes 40 secondes) est disponible en usant du fameux clic gauche sur la capture d’image ci-dessous. Cette vidéo vaut surtout pour l’accent mis sur les précautions indispensables pour l’étude d’un échantillon précieux fossilisé… et dont l’ADN, peu abondant, peut être fragmenté. En outre, des mesures simples mais draconiennes permettent de limiter les sources de contaminations, quand l’ADN moderne peut polluer l’ADN fossile. Le port de sur-chausses, de masque et les changements de blouses, le non croisement des échantillons avant et après amplification sont autant de précautions mises en avant dans cette vidéo… une occasion de visiter virtuellement les laboratoire de l’Institut Jacques Monod.
L’une des problématiques liées à l’étude de l’ADN « fossile » réside dans sa faible quantité disponible. Plusieurs méthodes de biologie moléculaire ont été envisagées pour amplifier ce matériel génétique afin d’en permettre l’expertise. Une publication dans BMC Genomics de 2006, Assessment of whole genome amplification-induced bias throughhigh-throughput, massively parallel whole genome sequencing, relate la comparaison de 3 méthodes d’amplifications pan-génomiques (méthodes WGA pour Wide Genome Amplification) d’ADN qui pourra devenir ensuite la matrice suffisante d’un séquençage haut-débit.
– la PEP-PCR (Primer Extension Preamplification-PCR) : cette technique fait intervenir des amorces aléatoires aux conditions d’appariement à basse température (low melting temperature) qui initieront la PCR
référence : Zhang, L. et al. (1992) Whole genome amplification from a single cell: Implications for genetic analysis. Proc. Natl. Acad. Sci. USA 89, 5847
– la DOP-PCR (Degenerate Oligonucleotide Primed-PCR) : cette technique, quant à elle, fait intervenir des amorces semi-dégénérées (de type : CGACTCGAGNNNNNNATGTGG) qui ont une température d’hybridation supérieure à celles utilisées dans la PEP-PCR
référence : Telenius, H. et al. (1992) Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer. Genomics 13, 718.
L’utilisation d’une Taq PCR limite la taille des fragments néo-synthétisés qui ne dépassent guère 3 kb. En outre, ces deux techniques, à l’instar de ce qui peut être démontré dans la publication de BMC Genomics 2006 (mentionnée ci-dessus), induisent des erreurs de séquences accompagnées de nombreux biais d’amplification (certaines régions ne sont pas amplifiées au profit de régions qui deviennent, de fait, sur-représentées).
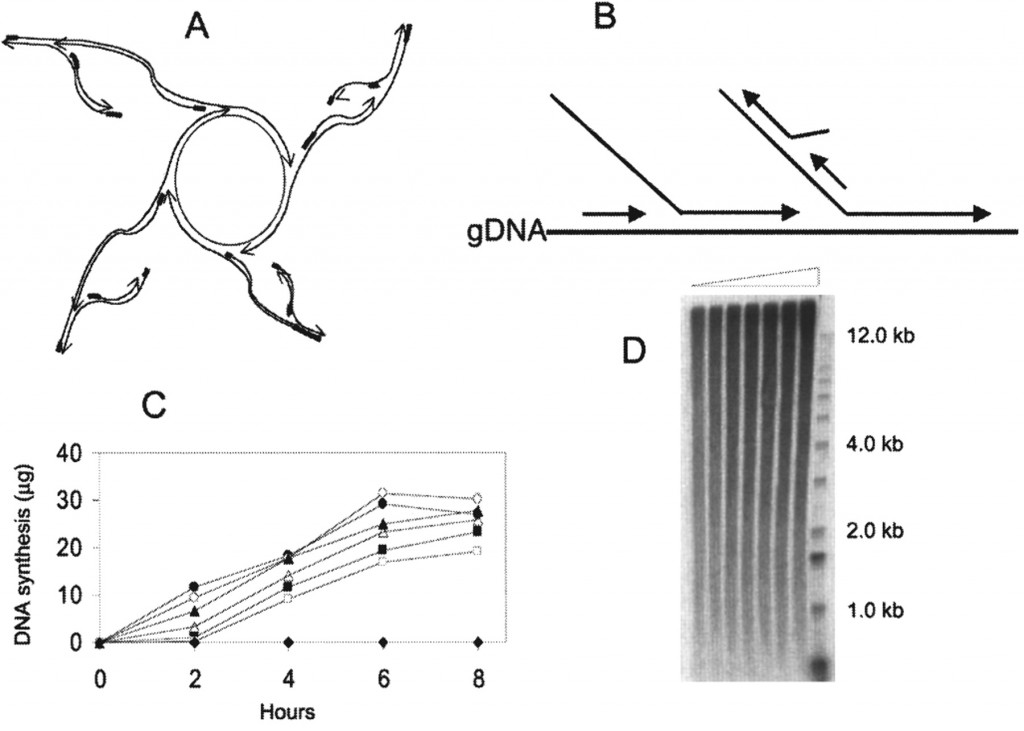
– la MDA (Multiple Displacement Amplification) : cette amplification iso-thermique fait intervenir des amorces aléatoires de type hexamères et une enzyme, la phi29. Le type d’amplification générée est schématisées sur la figure ci-dessous. L’enzyme surfe à partir du brin néo-synthétisé, déplace un brin complémentaire pour continuer sa synthèse. Ainsi, les brins générés par cette technique peuvent atteindre 100 kb. En outre, la phi29 possède une activité 3′ -> 5′ de relecture (proofreading) lui conférant un taux d’erreur 100 fois moindre que ceux constatés pour des Taq polymérases classiquement utilisées dans les techniques de PEP- ou DOP-PCR
source : Cold Spring Harb Protoc 2011.2011: pdb.prot5552 (la légende originale de la figure est disponible en cliquant sur celle-ci)
Ces techniques d’amplification pangénomique ont rendu possible l’étude d’ADN anciens et peu abondants et tout naturellement elles ont trouvé leur place dans la boîte à outils moléculaires des paléogénéticiens. Cependant, la révolution des séquençages haut-débit (dont nous avons abordé le sujet à plusieurs reprises) laisse entrevoir un nouveau champ des possibles pour l’étude des ADN fossiles. Au fond, des technologies telles que celle développée par Helicos Biosciences, trouvent ici un réel champ d’application à l’instar de ce que développe la publication True single-molecule DNA sequencing of a pleistocene horse bone de Genome Research, 2011- nulle nécessité d’amplifier la matrice de départ. Cette publication compare des technologies de séquençage de 2ème et 3ème générations (GaIIx et Helicos) appliquées au séquençage de l’ADN isolé à partir d’un os de cheval pleistocène conservé dans permafrost. Le séquençage « single molecule« , une chance pour la paléogénomique !
- des fiches logiciels (classement, descriptions et lien pointant vers l’hébergeur de ceux-ci)
- des fiches ressources (site internet, évènements, documents utiles…)
- mutualiser les compétences sur les logiciels
- promouvoir les développements internes
- animer une communauté autour du logiciel
- promouvoir l’usage des logiciels libres et la contribution à leur élaboration
 Noblegen Biosciences, start-up localisée dans le Massachusetts, ambitionne de commercialiser pour 2014 « optipore » (pour « optical detection » et « nanopore ») , un séquenceur de paillasse de troisième génération combinant nanotechnologies et un système de lecture optique permettant de réduire drastiquement les coûts de séquençage. L’objectif est de conquérir le marché des laboratoires cliniques dans la perspective de l’émergence d’une médecine personnalisée et de proposer ainsi un séquençage de génome humain complet à faible coût et dans un temps record. Dans cette course engagée, la société américaine se trouve en bonne position.
Noblegen Biosciences, start-up localisée dans le Massachusetts, ambitionne de commercialiser pour 2014 « optipore » (pour « optical detection » et « nanopore ») , un séquenceur de paillasse de troisième génération combinant nanotechnologies et un système de lecture optique permettant de réduire drastiquement les coûts de séquençage. L’objectif est de conquérir le marché des laboratoires cliniques dans la perspective de l’émergence d’une médecine personnalisée et de proposer ainsi un séquençage de génome humain complet à faible coût et dans un temps record. Dans cette course engagée, la société américaine se trouve en bonne position.
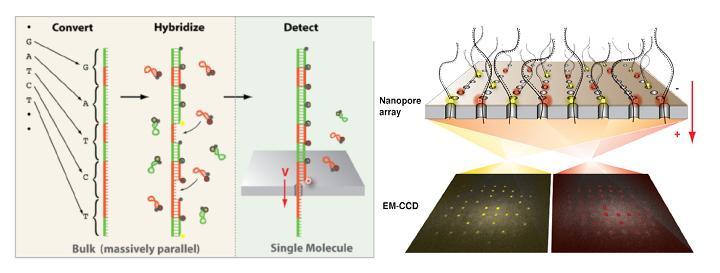
A l’instar du PGM Ion torrent, une puce en silicium constitue le coeur de la machine et renferme des centaines de nanopores. 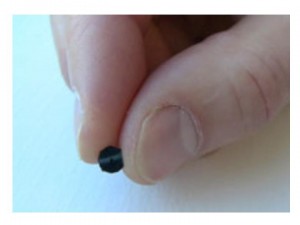 La molécule d’ADN unique native destinée à être séquencée est tout d’abord convertie en une nouvelle molécule synthétique transformant chaque base par une séquence nucléotidique spécifique correspondante. A chacune des quatre signatures nucléotidiques correspond un « molecular beacon » complémentaire fluorescent initialement inactivé par un système de « quencher ». Leurs hybridations au brin néoformé aboutit à un ADN double brin. la molécule est dirigé vers les nanopores par des échanges ioniques et en raison de la taille des orifices, les « molecular beacon » sont contraints à se deshybrider libérant cette fois une fluorescence, lue par un capteur photographique de type CMOS, qui est traduite en séquence.
La molécule d’ADN unique native destinée à être séquencée est tout d’abord convertie en une nouvelle molécule synthétique transformant chaque base par une séquence nucléotidique spécifique correspondante. A chacune des quatre signatures nucléotidiques correspond un « molecular beacon » complémentaire fluorescent initialement inactivé par un système de « quencher ». Leurs hybridations au brin néoformé aboutit à un ADN double brin. la molécule est dirigé vers les nanopores par des échanges ioniques et en raison de la taille des orifices, les « molecular beacon » sont contraints à se deshybrider libérant cette fois une fluorescence, lue par un capteur photographique de type CMOS, qui est traduite en séquence.
L’ensemble des études et preuves de faisabilité sur lesquelles repose la technologie de séquençage « optipore » sont décrites et détaillées au travers de l’article libre d’accès ci dessous: A ce jour, peu de caractéristiques techniques liées à cette plateforme filtrent mais Frank Feist, cofondateur de la société, annonce une capacité de séquençage de 500 Gb/heure. De plus, en raison de l’étape de conversion initiale, la taille des fragments serait limitée à 200 bases.
A ce jour, peu de caractéristiques techniques liées à cette plateforme filtrent mais Frank Feist, cofondateur de la société, annonce une capacité de séquençage de 500 Gb/heure. De plus, en raison de l’étape de conversion initiale, la taille des fragments serait limitée à 200 bases.
Un soutien de 4,2 millions de dollars en septembre dernier de la part du National Human Genome Research Institute devrait permettre à la société américaine de conforter cette avancée prometteuse.

Cet article revient sur une publication de janvier 2012 de Science (voir image ci-dessous) qui exploite des données de biologie haut-débit pour répondre à deux questions biologiques liées : « comment a été permise la photosynthèse ? » – « toutes les plantes ont elles un ancêtre commun?«
Les auteurs exploitent des données génomiques et transcriptomiques d’un glaucophyte : Cyanophora paradoxa. Cyanophora paradoxa est le biflagellé le plus étudié des glaucophytes, pris pour modèle dans l’étude de l’endosymbiose et pour ce qui a trait à la fonction du proplaste à l’origine des chloroplates.
Ces proplastes ayant pour origine l’intégration par endosymbiose d’une cyanobactérie (les mitochondries quant à elles, ayant pour origine l’endosymbiose d’une alpha-protéobactérie). L’intégration de ces données apporte la preuve que toutes les plantes seraient issues d’un seul ancêtre commun: les plantes formeraient une lignée monophylétique.
Il y a plus d’un milliard d’années a eu lieu la rencontre entre une cyanobactérie et une cellule eucaryote : de cette rencontre a émergé des cellules capables d’exploiter la lumière solaire pour synthétiser de la matière organique. L’étude présentée ici distingue :
– les EGT (Endosymbiotic Gene Transfer) avec les échanges de gènes entre le génome de l’hôte et celui de la cyanobactérie initiale venant grandement enrichir le génome de cet hôte. La participation des gènes de cyanobactérie représenterait entre 6 % (pour Chlamydomonas reinhardtii) et 18 % (pour Arabidopsis thaliana). Chez C. paradoxa, 274 gènes semblent avoir une origine cyanobactérienne. L’étude de la séquence mitochondriale a permis de positionner les glaucophytes très près du point de divergence des algues vertes et rouges.
– une autre source d’apport de matériel génétique venant enrichir ce système : les transferts de gènes horizontaux (HGT). Les auteurs dénombrent 15 gènes qui sont partagés par les 3 taxons de plantes à l’origine d’une diversité de plantes, et qui auraient une origine bactérienne – des séquences proches de celles retrouvées chez des Chlamydiae et Legionella, des parasites intracellulaires de cellules eucaryotes.
Ainsi les gènes apportés par le parasite ont permis au couple cyanobactérie-cellule de fournir des gènes nécessaires aux échanges de « nourriture » (UhpC-type hexosephosphate transporters, des sous-unités de translocons). Cette étude démontre que ces échanges de gènes ont une signature unique chez les plantes, les algues et les glaucophytes confortant la thèse d’une lignée végétale monophylétique, un coup porté aux tenants de la thèse de la « paraphylie végétale ».
Cet article de Science est un bel exemple de l’exploitation, de l’intégration et enfin de l’interprétation donnant sens aux données génomiques et transcriptomiques générées à haut-débit (des données de transcriptomiques -réalisées sur la plateforme Illumina GAIIx- sont disponibles dans la banque du NCBI : Sequence Read Archive avec les n° d’accès suivants SRX104482, SRX104481, SRX104480).
La confusion entre mate-pair et paired-end, tant au niveau technologique (selon qu’on lise les notes techniques d’Illumina, de Roche ou de Life) que logiciel nous a mené à rédiger, en collaboration avec Ségolène Caboche, Bioinformaticienne à l’université de Lille2, une note technique dont le contenu est résumé ci-dessous :
– Genèse de la confusion entre mate-pair et paired-end
– Descriptions les deux approches, avec un focus sur les principales technologies de seconde génération de séquenceurs
– Traitement au niveau logiciel et conseils généralistes pour l’utilisation
Le document est consultable dans son intégralité sur notre blog :
Télécharger Paired-end versus mate-pair
Bonne lecture!
 L’AGBT qui a eu lieu du 15 au 18 février, à Marco Island, a fait la part belle à la technologie d’Oxford Nanopore, ainsi qu’il avait été prévu. La société dont il est question a profité du rassemblement pour lever le voile sur 2 produits : le MinION et le GridION, il est à noter que le MinION, mini-système de séquençage de la taille d’une grosse clé USB (photo ci-contre) a une dénomination commerciale tout particulièrement adaptée au marché français.
L’AGBT qui a eu lieu du 15 au 18 février, à Marco Island, a fait la part belle à la technologie d’Oxford Nanopore, ainsi qu’il avait été prévu. La société dont il est question a profité du rassemblement pour lever le voile sur 2 produits : le MinION et le GridION, il est à noter que le MinION, mini-système de séquençage de la taille d’une grosse clé USB (photo ci-contre) a une dénomination commerciale tout particulièrement adaptée au marché français.
La technologie d‘Oxford Nanopore a été évoquée dans plusieurs de nos articles. Elle permet le séquençage et l’analyse à haut-débit de reads de taille ultra longue (plusieurs kb) en temps réel pour pas très cher : la promesse d’un séquençage de 3ème génération démocratisé. Clive G. Brown (directeur de la technologie chez Oxford Nanopore) a présenté ses deux nouveaux jouets :
– Le MinION (dont le prix serait inférieur à 900 $) est un consommable et séquenceur (les deux à la fois) jetable qui devrait permettre de générer 1 Gb de données
– Le GridION (que vous pouvez empiler à foison, voire photo ci-dessous) permet quant à lui de générer, par module, plusieurs dizaines de Gb / jour (on pencherait pour un minimum de 25 Gb) sachant que selon nos informations un module aurait un coût voisin de 30 k$. Oxford Nanopore insiste sur le fait qu’à la Gb générée ils seront concurrentiels en terme de coût des consommables. En outre, le volume de données générées s’adapte à la problématique de l’utilisateur puisqu’en effet tant que l’appareil séquence -d’où leur slogan « Run Until« – il génère des données (le débit journalier associé à une technologie prend tout son sens ici). La cartouche –consommable de séquençage– associée à la technologie GridION possède actuellement 2000 pores individuelles -en 2013, il est prévu de passer à un consommable en comportant 8000- avec cette évolution il sera donc possible avec 20 modules GridION (environ l’investissement équivalent à un HiSeq2000) de séquencer un génome humain en 15 minutes ! Une autre façon de voir les chose est la suivante, dans sa version « actuelle » à 2000 pores disponibles : pour un prix équivalent à celui d’une configuration de type Ion Proton, 5 modules GridION seront capables de séquencer un génome humain à 30 X (cela leur prendrait une demie journée).
D’autres éléments ont filtré lors de l’AGBT. En effet, il semblerait que la technologie d’Oxford Nanopore subisse un taux d’erreurs sur séquences brutes encore assez élevé de 4 % (comparé aux plus de 10 % pour la technologie de Pacific Bioscience). Clive G. Brown aurait laissé entendre que ce taux d’erreurs serait uniforme et le fruit d’une majorité d’erreurs systématiques (ce qui est plutôt bon signe, en vue d’une rapide amélioration du système). Au niveau du système de détection, une puce GridION comporte 2K capteurs (un par pore). Chaque capteur permet de distinguer 64 signaux différents, ceci a permis d’analyser le passage de triplets de base afin de pouvoir discriminer 4x4x4 profils différents (j’avoue que j’attendais plus : quid de la prise en compte d’un signal différentiel en cas de présence d’une 5-méthylcytosine ?).
Au niveau préparation des échantillons, un séquenceur de 3ème génération ne nécessite pas de phase d’amplification. Hormis une phase préalable de légère fragmentation de l’échantillon rien ne semble envisagé. Pour palier leur problème de fiabilité, on imagine aisément qu’à l’instar de Pacific Bioscience, une circularisation de l’ADN de l’échantillon permettra d’engendrer en séquençage un nombre suffisant de répétitions venant atténuer ce point négatif.
Un élément important -mais pas surprenant- réside dans la politique commerciale affichée : une distribution directe des machines ainsi qu’une adaptation tarifaire (en usant de forfaits) offrant la possibilité d’acheter la machine à prix réduit avec un report sur le coût des consommables devrait permettre à Oxford Nanopore de conquérir quelques marchés n’en doutons pas !
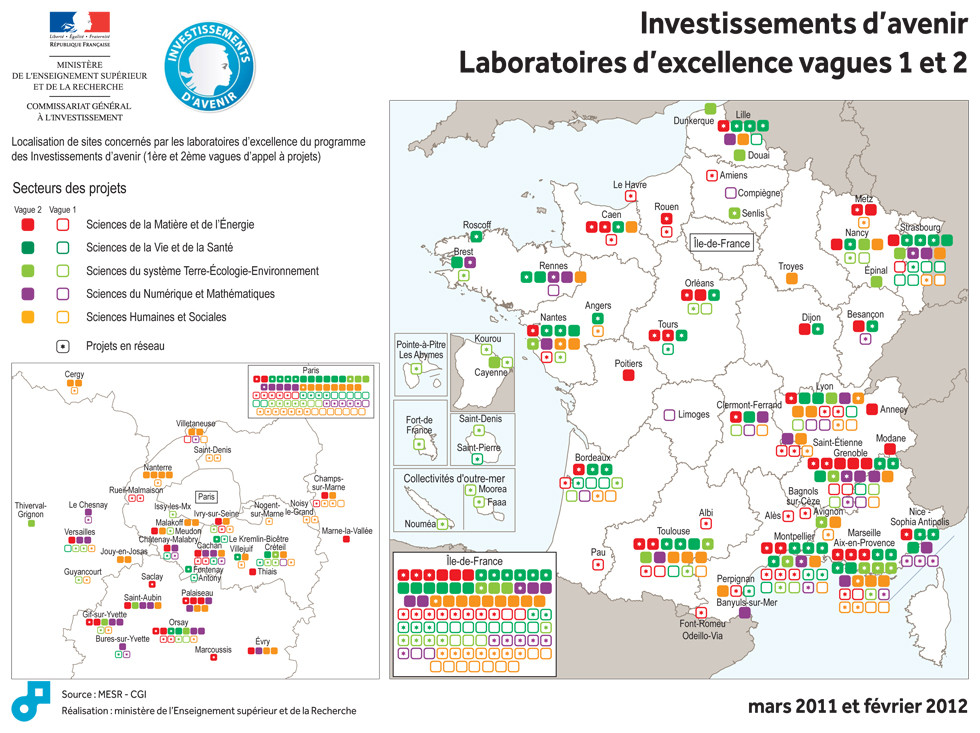
 Laurent Wauquiez, ministre de l’Enseignement supérieur et de la Recherche, et Jean-Luc Tavernier, Commissaire général adjoint à l’Investissement, ont annoncé la liste des 71 lauréats de la deuxième vague de l’appel à projets « LABoratoires d’EXcellence« -fameux LABEX- doté d’une enveloppe de 1 milliard d’euros. La gestion du contenu de cette enveloppe a été confiée à l’Agence Nationale de la Recherche.
Laurent Wauquiez, ministre de l’Enseignement supérieur et de la Recherche, et Jean-Luc Tavernier, Commissaire général adjoint à l’Investissement, ont annoncé la liste des 71 lauréats de la deuxième vague de l’appel à projets « LABoratoires d’EXcellence« -fameux LABEX- doté d’une enveloppe de 1 milliard d’euros. La gestion du contenu de cette enveloppe a été confiée à l’Agence Nationale de la Recherche.
Voici un extrait du site : investissement-avenir.gouvernement.fr qui revient sur le bilan des dotations suite à cette deuxième vague du concours de l’excellence au service de la science… ou l’inverse… on ne sait plus trop :
« L’appel à projets a pour objectif d’attribuer aux laboratoires sélectionnés des moyens significatifs leur permettant d’accroître leur visibilité internationale, de faire jeu égal avec leurs homologues étrangers, d’attirer des chercheurs et des enseignants-chercheurs de renommée internationale et de construire une politique intégrée de recherche, de formation et de valorisation de très haut niveau.
195 projets ont été reçus pour cet appel et 71 ont été retenus (soit l’ensemble des projets classés A+ à A5 par un jury international, présidé par le Professeur Jean Claude Latombe, Professeur à l’université de Stanford).
Ces 71 laboratoires seront financés jusqu’en 2020 pour un montant de 534,5 M€, sachant que certains de ces laboratoires se trouveront financés dans le cadre des 8 Initiatives d’excellence désormais reconnues.
Les lauréats recevront dans les toutes prochaines semaines un acompte de 10% afin que les équipes sélectionnées puissent lancer leur projet dans les meilleurs délais.
Avec les lauréats de la première vague, ce sont donc 171 laboratoires d’excellence qui auront été sélectionnés pour un financement sur une période suffisamment longue pour leur permettre de déployer une stratégie scientifique de grande ampleur.
L’ensemble des domaines de recherche est représenté au terme de ces deux appels à projets : 14,5% en sciences du numérique et des mathématiques, 24% en sciences humaines et sociales, 20 % dans le domaine de la matière et de l’énergie, 14,6% dans le domaine des sciences de la terre et de l’environnement, 26,9% dans le secteur de la biologie-santé. »
Vous pourrez trouver le communiqué de presse comportant la liste des projets retenus accompagnée d’un court descriptif incluant les retombées économico-scientifico-sociales attendues (retour sur investissement) –> ici. Il vous suffit ou presque de regarder la carte présentée ci-dessus pour connaître les régions (ou villes universitaires) sur- ou sous-bénéficiants des investissements d’avenir… Lille devance légèrement Clermont-Ferrant et est supplantée par Strasbourg…
LABEX ou l’excellence… à tous les plats (nous avions abordé ce sujet précédemment). Une excellente lettre provenant de l’excellent blog d’Olivier Bouba-Olga, « un économiste qui suit et commente l’actualité » est disponible ici. Je vous invite chaleureusement à prendre connaissance de cette missive titrée : « l’excellence des Universités : oui, mais quelle excellence ?! ». Quelques « concepts » accompagnant la notion subjective d’excellence y sont passés en revue : de la notion de masse critique à la loi de Lotka.
Lotka a été le premier à réaliser, en 1926, une étude sur la distribution des auteurs scientifiques, arrivant à la conclusion que la relation auteurs-articles est inversement proportionnelle au carré d’articles publiés (une distribution hyperbolique)… cette constatation serait la résultante de ce que l’on nomme (en sociologie) « l’effet Saint Mathieu » qui peut être énoncé ainsi : le succès engendre encore plus de succès (ou la richesse réelle ou symbolique plus de richesse réelle ou symbolique)… Ainsi, ici transposé, le « concours » LABEX concentre des fonds très importants sur des têtes d’affiche… Quand l’état adosse sa politique d’investissements -d’avenir- sur la scientométrie, l’instrument de mesure fausse la mesure… en science on appelle cela l’effet de l’instrument…
 Sequenom est une autre société californienne de biotechnologie (cotée au NASDAQ) basée à San Diego. Cette société développe des outils d’analyse génomique avec deux principales divisions:
Sequenom est une autre société californienne de biotechnologie (cotée au NASDAQ) basée à San Diego. Cette société développe des outils d’analyse génomique avec deux principales divisions:
– l’une d’elles développant des systèmes d’analyse génétique (type MassARRAY)
– l’autre se concentrant sur la recherche et développement de réactifs transférables sur la plateforme technologique développée par la première division.
Depuis 2008, Sequenom développe des outils analytiques de paillasse, les systèmes ‘MassARRAY’, appareillage compact permettant une mesure directe de la masse des acides nucléiques, offrant une précision inégalée quant à leur nature et leur quantification. Ce système, sur la base d’un spectromètre de masse, multi-MALDI-TOF MS, trouve des applications pour le génotypage, l’ analyse de la méthylation et l’expression génique. Sequenom continue d’affiner ces applications et de développer plusieurs nouvelles applications pour l’analyse de CNV (Copy Number Variation) par exemple.
Cette technologie est chahutée par les séquenceurs haut-débits de paillasse et autres systèmes permettant de génotyper une grande quantité d’échantillons tels que les systèmes proposés par Fluidigm. Le système MassARRAY bénéficie d’une sensibilité hors pair, les kits diagnostiques développés sur leur plateforme permettent à Sequenom de faire perdurer leur technologie. Les kits diagnostiques prénataux comme le MaternitT21 offre une alternative à l’amniocentèse pour diagnostiquer les trisomies 21, (en février 2012, Sequenom a lancé le MaterniT21 PLUS, permettant de diagnostiquer les trisomies 21, 18 et 13) de manière non invasive ciblant l‘ADN fœtal circulant dans le système sanguin maternel. Après des suspicions quant à un délit d’initié potentiel, des cadres de Sequenom sont surveillés par la SEC (Securities and Exchange Commission), de plus le développement des kits diagnostiques prénataux a connu des difficultés en 2010. En effet, la société a été condamnée à verser 14 millions de USD pour régler un recours (en « class-action ») : des actionnaires se sont retournés sur la société considérant que le développement du kit diagnostique de la trisomie 21 avait été plus que mal géré (notamment au niveau des essais cliniques).
La technologie MassARRAY est encore très employée pour le passage de cohortes suite à des études d’associations génétiques (les puces haute-densité sont employées dans un premier temps, suivi du passage des loci candidats sur une plateforme plus souple, telle que le MassARRAY, permettant d’interroger les mutations putativement associées au phénotype étudié). Un document en lien ici, reprend les principales caractéristiques de la plateforme de génotypage.
Bien que la plateforme MassARRAY trouve vite ses limites, la société Sequenom s’emploie à développer des solutions diagnostiques qui retardent l’obsolescence de leur technologie. La société a connu des soubresauts économico-judiciaires dont elle a su se relever, elle tente d’accélérer la diffusion de plusieurs de ces kits diagnostiques avant que sa technologie ne soit dépassée par la concurrence.
Qui sommes nous?
Christophe Audebert [@]
 En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
Renaud Blervaque [@]
 Biologiste moléculaire, chargé d'études génomiques.
Biologiste moléculaire, chargé d'études génomiques.
Gaël Even [@]
 Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Catégories
- Analyse de données (14)
- Automatisation (5)
- Bioinformatique (27)
- Biologie (56)
- biologie transverse (35)
- Biotechnologie (30)
- Chronique littéraire (8)
- Comparatif (6)
- Diagnostic (8)
- Economie (17)
- Epidemiologie (2)
- Evénement (17)
- Formation (3)
- Gestion de projet (5)
- Grille de calcul (1)
- Intégration (5)
- Logiciels (8)
- Médecine (14)
- politique de la recherche (17)
- Recherche (21)
- Séquençage (70)
- Séquenceur (39)
- Uncategorized (25)
- Workflow (4)
Accès rapide aux articles
- Covid-19 : zoom sur les vaccins
- Comment l’ADN pourrait être le stockage de données du futur
- COVID-19 : la data visualisation au service de la science
- COVID-19 : des explications et un point d’étape au 20 février 2020
- Pour mettre du vin dans son eau
- Des petits trous, toujours des petits trous…
- Qui serait candidat ?
- Un robot pour analyser vos données…
- Monde de dingue(s)
- L’art et la manière de développer une qPCR
- Un MOOC Coursera sur le WGS bactérien
- Chercheurs & enseignants-chercheurs, l’art du multitâche.
- Un jeu de données métagénomiques
- Facteur d’impact
- Microbiote & smart city : juxtaposition de tendances
Accès mensuels
- février 2021 (1)
- décembre 2020 (1)
- février 2020 (2)
- septembre 2019 (1)
- avril 2018 (2)
- décembre 2017 (1)
- novembre 2017 (2)
- juillet 2017 (2)
- juin 2017 (5)
- mai 2017 (4)
- avril 2017 (3)
- mars 2017 (1)
- janvier 2017 (2)
- décembre 2016 (3)
- novembre 2016 (4)
- octobre 2016 (2)
- septembre 2016 (2)
- août 2016 (3)
- juillet 2016 (2)
- juin 2016 (4)
- mai 2016 (3)
- mars 2016 (1)
- novembre 2015 (2)
- avril 2015 (1)
- novembre 2014 (1)
- septembre 2014 (1)
- juillet 2014 (1)
- juin 2014 (1)
- mai 2014 (1)
- avril 2014 (1)
- mars 2014 (1)
- février 2014 (3)
- janvier 2014 (1)
- décembre 2013 (5)
- novembre 2013 (2)
- octobre 2013 (2)
- septembre 2013 (1)
- juillet 2013 (2)
- juin 2013 (2)
- mai 2013 (4)
- avril 2013 (2)
- mars 2013 (1)
- février 2013 (3)
- janvier 2013 (2)
- décembre 2012 (2)
- novembre 2012 (2)
- octobre 2012 (2)
- septembre 2012 (2)
- août 2012 (1)
- juillet 2012 (3)
- juin 2012 (5)
- mai 2012 (5)
- avril 2012 (6)
- mars 2012 (6)
- février 2012 (8)
- janvier 2012 (6)
- décembre 2011 (5)
- novembre 2011 (6)
- octobre 2011 (6)
- septembre 2011 (7)
- août 2011 (5)
- juillet 2011 (8)
Pages