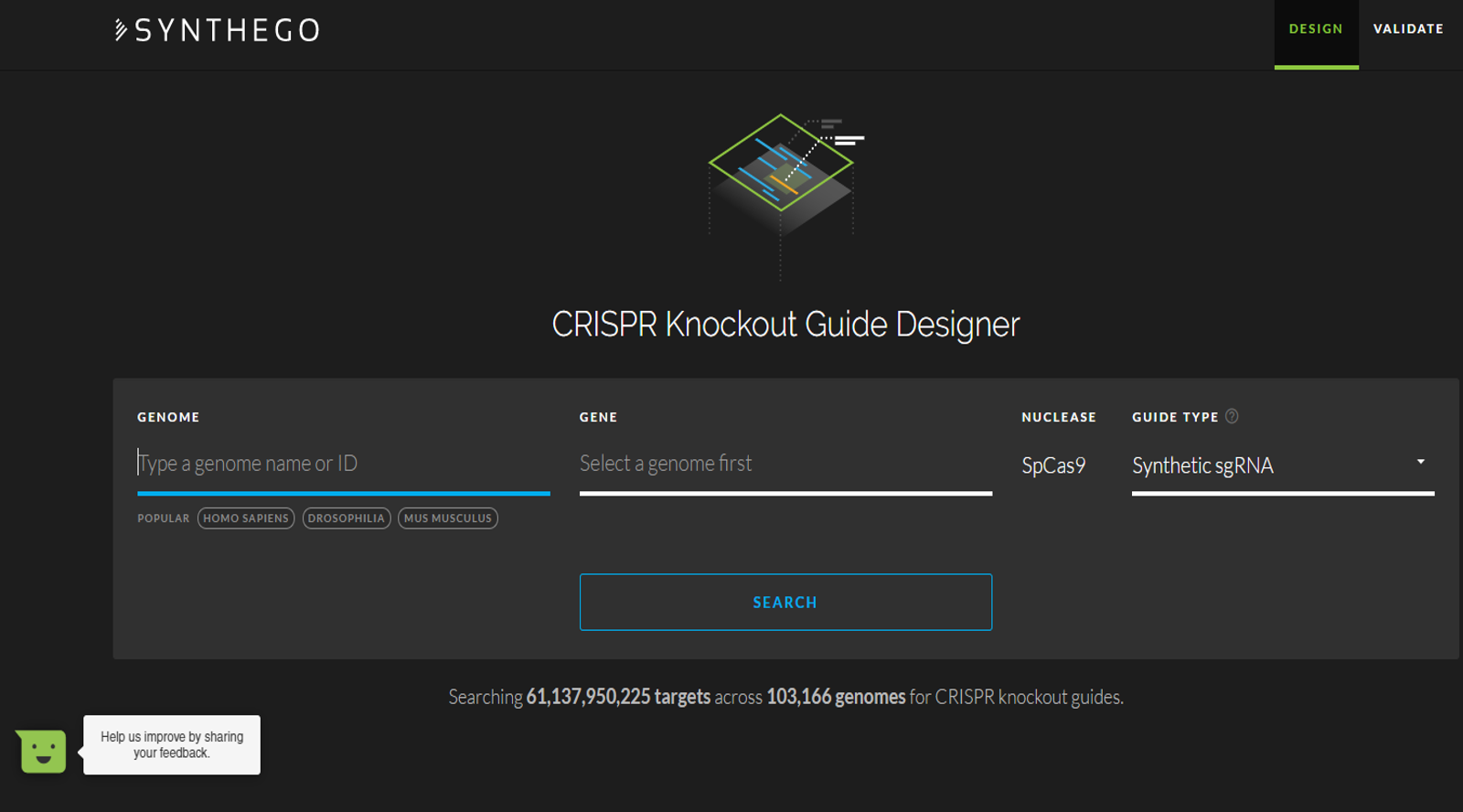
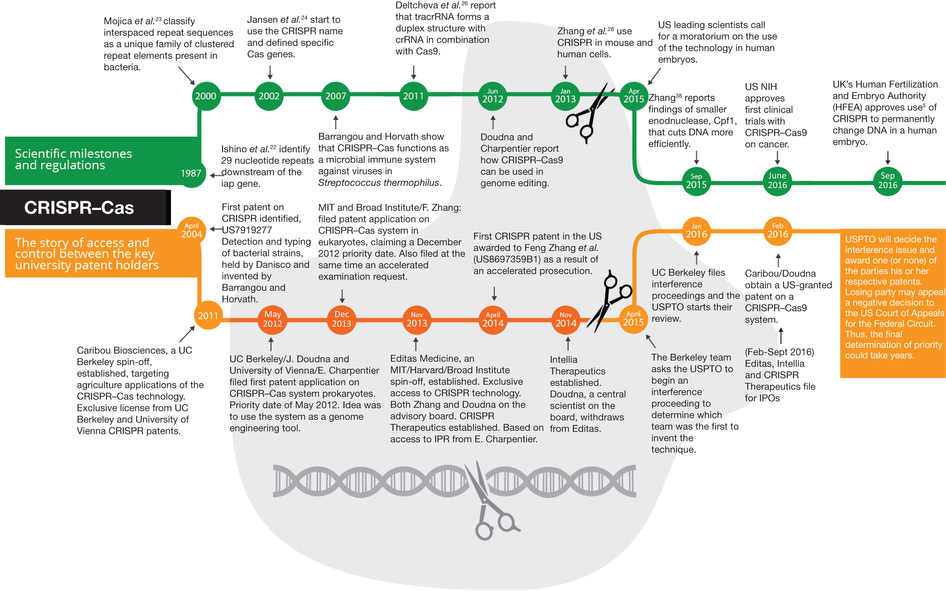
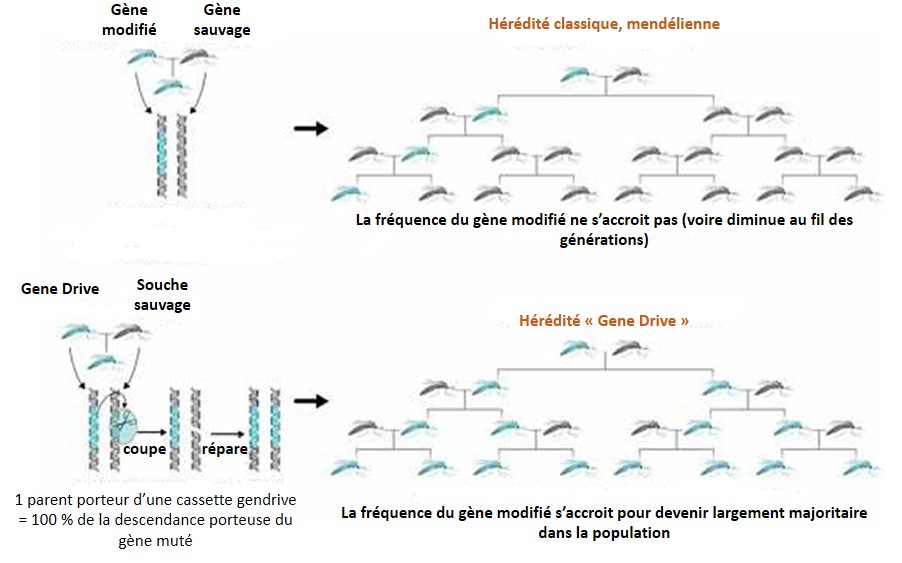
Voici un outil simplissime, rapide, en ligne, permettant de designer et de qualifier informatiquement des sgRNA, dans un contexte de KO réalisé par CRISPR/Cas9.
Vraiment pas mal !
Cliquez sur la capture d’écran ci-dessous et tentez votre design.
Cette figure (sur laquelle il vous faudra cliquer pour un meilleur confort de lecture) tirée de l’excellent article « The emerging patent landscape of CRISPR–Cas gene editing technology » (Nature Biotechnology – octobre 2016) vous permet d’appréhender le début de l’histoire de la technologie CRISPR/Cas9 et de vous présenter les acteurs de cette future saga de la propriété intellectuelle.
 A moins de sortir d’une longue phase d’hibernation, tout un chacun aura eu les oreilles rebattues par les applications liées à la technologie CRIPSR/Cas9, la révolution de l’édition de gènes (comprenez modification). Plus facile à mettre en oeuvre que les technologies TALEN et autres nucléases doigt de zinc (voir la table ci-dessous), cette technologie est tout à la fois moins onéreuse et nettement plus efficace. Cette technologie est souvent comparée, du fait de sa précision d’utilisation, à une méthode de micro-chirurgie. Un nombre exponentiel d’articles scientifiques et non scientifiques font le panégyrique de cette révolution qui est la conséquences des travaux de Jennifer Doudna et Emmanuelle Charpentier. Ces dernières ont permis de configurer cette technologie à partir de l’élucidation d’un mécanisme de vaccination primitif bactérien (nous reviendrons sur ce point fondamental dans un futur article).
A moins de sortir d’une longue phase d’hibernation, tout un chacun aura eu les oreilles rebattues par les applications liées à la technologie CRIPSR/Cas9, la révolution de l’édition de gènes (comprenez modification). Plus facile à mettre en oeuvre que les technologies TALEN et autres nucléases doigt de zinc (voir la table ci-dessous), cette technologie est tout à la fois moins onéreuse et nettement plus efficace. Cette technologie est souvent comparée, du fait de sa précision d’utilisation, à une méthode de micro-chirurgie. Un nombre exponentiel d’articles scientifiques et non scientifiques font le panégyrique de cette révolution qui est la conséquences des travaux de Jennifer Doudna et Emmanuelle Charpentier. Ces dernières ont permis de configurer cette technologie à partir de l’élucidation d’un mécanisme de vaccination primitif bactérien (nous reviendrons sur ce point fondamental dans un futur article).
| Technologie | Première utilisation | Première application sur animaux vivants | Echelle de temps pour la mise en œuvre |
| Zinc finger nucleases | 1996 | 2002 | mois / année |
| TALENs | 2010-2011 | 2011 | semaines |
| CRISPR/Cas9 | 2012 | 2012-2013 | jours |
Donc non ! il ne s’agit pas ici uniquement de contribuer à l’enthousiasme, certes communicatif, de cette révolution dans le domaine des biotechnologies qui est lui-même friand de ces révolutions qui se succèdent les unes aux autres… Il s’agit dans ce premier article abordant CRISPR/Cas9 de proposer un début de décryptage de ce qui se cache derrière la terminologie de Gene Drive, application de CRISPR/Cas9. Cette terminologie est encore une fois peu aisée à traduire à mi-chemin entre le pilotage et le forçage génétique. Quoi qu’il en soit derrière l’appellation Gene Drive, se cache une technologie qui mérite que l’on s’arrête pour pousser plus avant la réflexion, tant l’enfer est pavé de bonnes intentions… Pour faire monter la pression, il faut savoir que James Clapper, le directeur du renseignement national des États-Unis, a placé la technologie CRISPR mais surtout sa formulation « Gene Drive » au niveau des armes de destruction massive… rien que ça.
Gene Drive, technologiquement concentre dans une cassette, l’outil permettant d’accélérer sa propagation (les ciseaux permettant la microchirurgie sont embarqués et encodés au sein même du génome ciblé) ainsi que le gène que l’on souhaite voir introduire au niveau d’une espèce donnée, évidemment cette technologie s’intéresse principalement aux populations sauvages. Ainsi cette cassette possède sa propre capacité de propagation, échappant aux lois de Mendel. Correctement encodée au sein d’une partie de population « augmentée ou diminuée », une dizaine de générations d’individus se reproduisant de façon sexuée permet de faire en sorte que la cassette a contaminé l’intégralité ou l’extrême majorité de la population sauvage (voir le schéma ci-dessous). L’exemple souvent développé, sponsorisé par la Fondation Bill-et-Melinda-Gates, consiste à proposer aux dirigeants africains des anophèles modifiés par cette technologie pour être résistants au parasite, Plasmodium falciparum, l’agent du paludisme. Rappelons que 650 000 personnes meurent chaque année de la malaria (rapport OMS de 2013), principalement sur le continent africain. Toujours dans les bons coups, Bill, pour soigner son karma! Ce dernier oublie néanmoins que le moustique génétiquement modifié agent mutagène puisque porteur de la cassette Gene Drive ne s’arrête pas aux frontières… mais qu’importe le moyen technologique existe donc que ne serions nous pas de fâcheux obscurantistes à réfléchir aux conséquences de l’utilisation de cette technologie avant de l’employer la fleur au fusil. Les « obscures rabat-joie » souvent du côté des écologues s’opposent aux biologistes moléculaires, rapides prescripteurs d’une technologie prometteuse pour éradiquer un nombre substantiel de fléaux, quitte à modifier durablement la nature pour l’intérêt supérieur humain ou parfois même pour l’intérêt supérieur de quelques uns…
La technologie Gene Drive peut être utilisée pour :
• Éradiquer les maladies telles que le paludisme, la dengue, la fièvre jaune, virus du Nil occidental, la maladie du sommeil ainsi que beaucoup d’autres en modifiant les espèces d’insectes vecteurs des parasites, virus, bactéries causes de ces maladies
• Éradiquer les espèces envahissantes. Les dix premières espèces envahissantes aux États-Unis causent environ 42 milliards USD de dommages chaque année
• Certains évoquent avec beaucoup d’aplomb, l’utilisation de cette technologie pour une agriculture plus « durable » en inversant la résistance aux pesticides et aux herbicides. Cette fois c’est la plante résistante au glyphosate (la molécule du RoundUp) qui est ciblée.
Que de beaux et bons sentiments… en guise de promesses de cette technologie !
Les limites de la technologie :
• De « nombreuses » générations sont nécessaires pour répandre la mutation dans la population. La durée totale dépend du cycle de reproduction de l’organisme, du nombre d’individus porteurs de la cassette Gene Drive introduit initialement dans la population, de l’efficacité de la cassette et du flux génétique (transfert d’allèles d’une population à une autre). Par exemple, cela pourrait prendre quelques années pour modifier une population d’insectes. Si 10 individus d’une population étaient porteurs d’une cassette Gene Drive parmi une population constante de 100.000 organismes, il faudrait environ 16 générations – environ un an- pour se propager à 99% de la population sous de peu réalistes, conditions optimales.
• Cette technologie est inopérante sur des organismes ne reproduisant pas de façon sexuée comme les bactéries et les virus et aura des problèmes avec les espèces qui peuvent se reproduire de façon sexuée ou non, comme cela peut être le cas pour beaucoup de plantes.
• Certains types d’altérations devraient être réintroduites sans cesse. Par exemple, une cassette Gene Drive engendrant un trait qui est quelque peu nuisible à l’organisme finira par se « briser ». De même, une cassette engendrant une résistance aux herbicides inversée dans une mauvaise herbe aurait à lutter contre la sélection naturelle dans les zones où les herbicides ont été appliqués.
La technologie ouvre donc la boîte de Pandore de la modification génétique de population sauvage. Plus l’intervalle générationnel de la population cible sera court, plus l’objectif d’une population « panmutée » sera facile à atteindre. Ci-dessous vous pourrez avoir un excellent point concernant la technologie à l’aide du travail de « the National Academies of Sciences Engineering and Medicine ».
Qui sommes nous?
Christophe Audebert [@]
 En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
En charge de la plateforme génomique
du département recherche et développement
de la société Gènes Diffusion .
Renaud Blervaque [@]
 Biologiste moléculaire, chargé d'études génomiques.
Biologiste moléculaire, chargé d'études génomiques.
Gaël Even [@]
 Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Responsable bioinformatique au sein
du département recherche et développement de la société Gènes Diffusion.
Catégories
- Analyse de données (14)
- Automatisation (5)
- Bioinformatique (27)
- Biologie (56)
- biologie transverse (35)
- Biotechnologie (30)
- Chronique littéraire (8)
- Comparatif (6)
- Diagnostic (8)
- Economie (17)
- Epidemiologie (2)
- Evénement (17)
- Formation (3)
- Gestion de projet (5)
- Grille de calcul (1)
- Intégration (5)
- Logiciels (8)
- Médecine (14)
- politique de la recherche (17)
- Recherche (21)
- Séquençage (70)
- Séquenceur (39)
- Uncategorized (25)
- Workflow (4)
Accès rapide aux articles
- Covid-19 : zoom sur les vaccins
- Comment l’ADN pourrait être le stockage de données du futur
- COVID-19 : la data visualisation au service de la science
- COVID-19 : des explications et un point d’étape au 20 février 2020
- Pour mettre du vin dans son eau
- Des petits trous, toujours des petits trous…
- Qui serait candidat ?
- Un robot pour analyser vos données…
- Monde de dingue(s)
- L’art et la manière de développer une qPCR
- Un MOOC Coursera sur le WGS bactérien
- Chercheurs & enseignants-chercheurs, l’art du multitâche.
- Un jeu de données métagénomiques
- Facteur d’impact
- Microbiote & smart city : juxtaposition de tendances
Accès mensuels
- février 2021 (1)
- décembre 2020 (1)
- février 2020 (2)
- septembre 2019 (1)
- avril 2018 (2)
- décembre 2017 (1)
- novembre 2017 (2)
- juillet 2017 (2)
- juin 2017 (5)
- mai 2017 (4)
- avril 2017 (3)
- mars 2017 (1)
- janvier 2017 (2)
- décembre 2016 (3)
- novembre 2016 (4)
- octobre 2016 (2)
- septembre 2016 (2)
- août 2016 (3)
- juillet 2016 (2)
- juin 2016 (4)
- mai 2016 (3)
- mars 2016 (1)
- novembre 2015 (2)
- avril 2015 (1)
- novembre 2014 (1)
- septembre 2014 (1)
- juillet 2014 (1)
- juin 2014 (1)
- mai 2014 (1)
- avril 2014 (1)
- mars 2014 (1)
- février 2014 (3)
- janvier 2014 (1)
- décembre 2013 (5)
- novembre 2013 (2)
- octobre 2013 (2)
- septembre 2013 (1)
- juillet 2013 (2)
- juin 2013 (2)
- mai 2013 (4)
- avril 2013 (2)
- mars 2013 (1)
- février 2013 (3)
- janvier 2013 (2)
- décembre 2012 (2)
- novembre 2012 (2)
- octobre 2012 (2)
- septembre 2012 (2)
- août 2012 (1)
- juillet 2012 (3)
- juin 2012 (5)
- mai 2012 (5)
- avril 2012 (6)
- mars 2012 (6)
- février 2012 (8)
- janvier 2012 (6)
- décembre 2011 (5)
- novembre 2011 (6)
- octobre 2011 (6)
- septembre 2011 (7)
- août 2011 (5)
- juillet 2011 (8)
Pages